当酸溶液遇到了更多的水时...
By 苏剑林 | 2010-10-31 | 21376位读者 |BoJone:阅读本文需要有电离平衡的相关知识作为基础。
这两个星期我们都在学习高中的人教版《化学选修4》中的电离平衡相关知识。虽然我们是“重点班”,可是进展仍然相当地慢。关于电离平衡,有同学向我提出过一个问题:
酸溶液继续加水后,为什么pH会趋于7?(常温常压)
显然,这个问题是很好理解的,因为加水后$H^+$被稀释了。然后我更感兴趣是由此引申出的一个问题:
(强)酸溶液继续加水后,平衡向哪边移动?
也许有的朋友马上想到:加水后氢离子的浓度降低了,应该向氢离子浓度升高的方向进行,所以平衡向右移。这样想的读者忽略了另外一个现象:水中本来就存在着氢离子和氢氧根离子,水中的氢氧根离子会导致混合后的氢氧根离子浓度升高,那么如此说来应该要想氢氧根离子浓度减少的方向移动(逆方向)?这样两个矛盾的结论,孰对孰错?
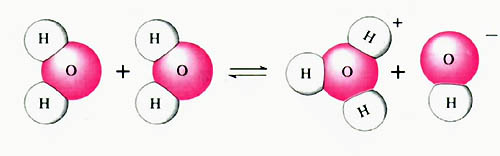
学习了电离知识的朋友都知道,强酸是完全电离的,因此其水溶液中只存在着一个电离平衡
应该说,任何水溶液中都存在这个平衡。其中,当温度一定时,氢离子和氢氧根离子的浓度之积除以水浓度等于常数(浓度是物质的量浓度),即
$$\frac{c(H^+)\cdot c(OH^-)}{c(H_2 O)}=K$$
由于$c(H_2 O)\approx 1$,因此近似地把$c(H^+)*c(OH^-)=K_w$视为常熟,成为水的离子积。为了相对精确讨论我们刚才提出的第二个问题,我们不用近似结果。
我们原来的酸、加入的水,以及加入瞬间的混合溶液的浓度情况列出来:
其中酸和水在混合之前都达到了平衡,即
$$\frac{c_1 c_2}{c_3}=\frac{c_4^2}{c_5}=K$$
要判断混合后平衡究竟想哪边移动,但看$\frac{c(H^+)*c(OH^-)}{c(H_2 O)}$与K相比孰大孰小。可以计算
$$\begin{aligned}\frac{c_1 V_1+c_4 V_2}{V_1+V_2}\cdot \frac{c_1 V_2+c_4 V_2}{V_1+V_2} -: \frac{c_3 V_1+c_5 V_2}{V_1+V_2} \\ =\frac{V_1^2 c_1 c_2 +V_2^2 c_4^2 + V_1 V_2 (c_4 c_2+c_1 c_4)}{V_1^2 c_3+V_2^2 c_5+V_1 V_2 (c_3+c_5)}\end{aligned}\tag{1}$$
因为原来是酸溶液,应该有$c_1 > c_4 >c_2$,因此$(c_4-c_2)(c_1-c_4) > 0$,由此推得
$$c_4 c_2 +c_1 c_4 > c_4^2 +c_1 c_2$$
把上式连同$c_1 c_2=K c_3,c_4^2=K c_5$代入(1),可以得到
$$\frac{c_1 V_1+c_4 V_2}{V_1+V_2}\cdot \frac{c_1 V_2+c_4 V_2}{V_1+V_2} -: \frac{c_3 V_1+c_5 V_2}{V_1+V_2} > K$$
因此反应必须向逆方向进行(生成水的方向)。
转载到请包括本文地址:https://kexue.fm/archives/1042
更详细的转载事宜请参考:《科学空间FAQ》
如果您还有什么疑惑或建议,欢迎在下方评论区继续讨论。
如果您觉得本文还不错,欢迎分享/打赏本文。打赏并非要从中获得收益,而是希望知道科学空间获得了多少读者的真心关注。当然,如果你无视它,也不会影响你的阅读。再次表示欢迎和感谢!
如果您需要引用本文,请参考:
苏剑林. (Oct. 31, 2010). 《当酸溶液遇到了更多的水时... 》[Blog post]. Retrieved from https://kexue.fm/archives/1042
@online{kexuefm-1042,
title={当酸溶液遇到了更多的水时...},
author={苏剑林},
year={2010},
month={Oct},
url={\url{https://kexue.fm/archives/1042}},
}











October 31st, 2014
长见识了